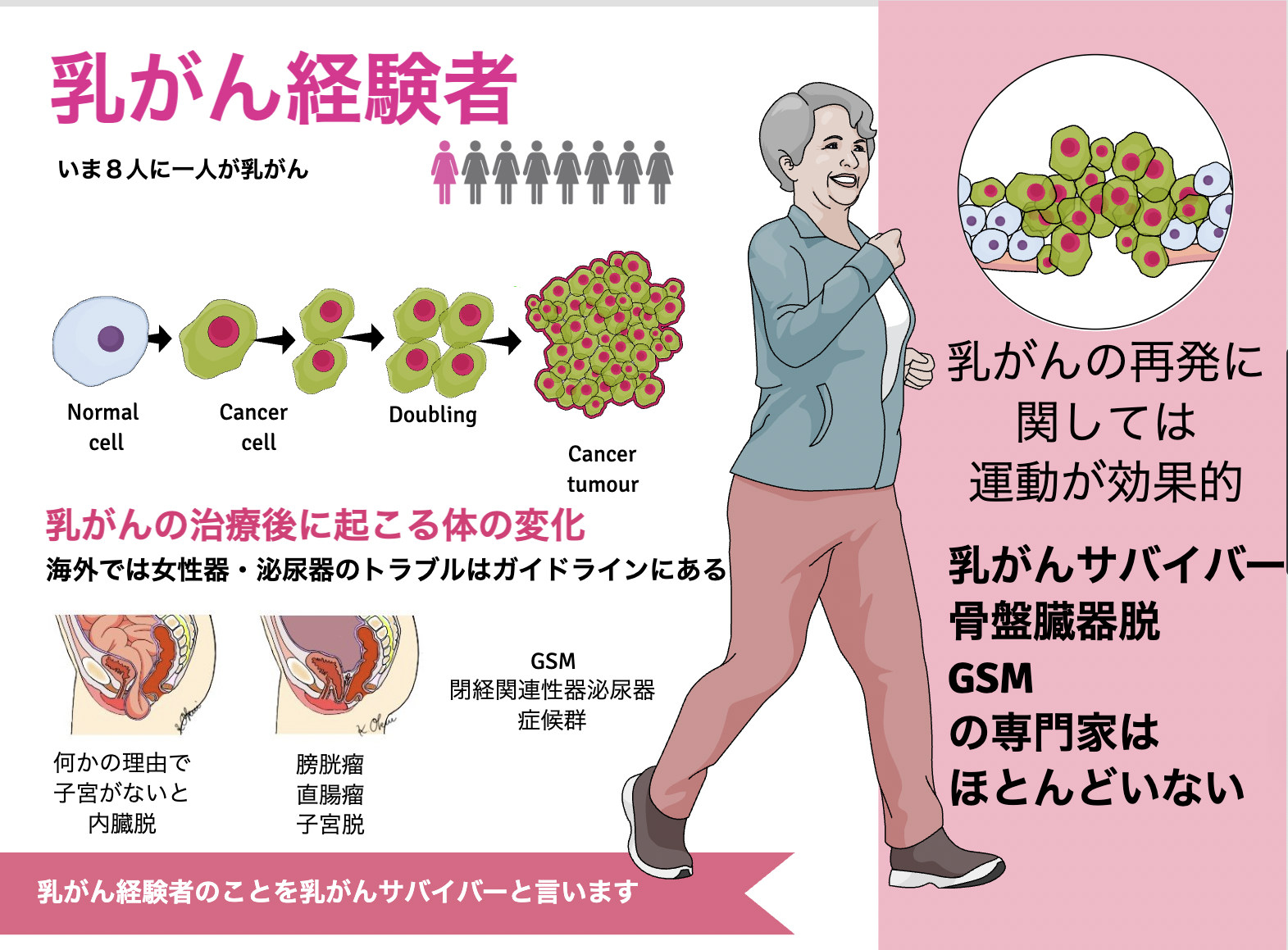
乳がんサバイバーの女性泌尿器科治療マニュアル
世界的に乳がんサバイバーが、女性泌尿器科の疾患になった場合のマニュアルがありません。ヨーロッパで知られているのは、乳がんサバイバーの骨粗鬆症とGSM(閉経関連性器泌尿器)が知られていますが、日本では乳がんサバイバーのGSMは積極的に診療されているとは言えません。そこで、この分野の英語査読論文を集めて、治療マニュアルを作成しようと言うのが、今回の目的です。
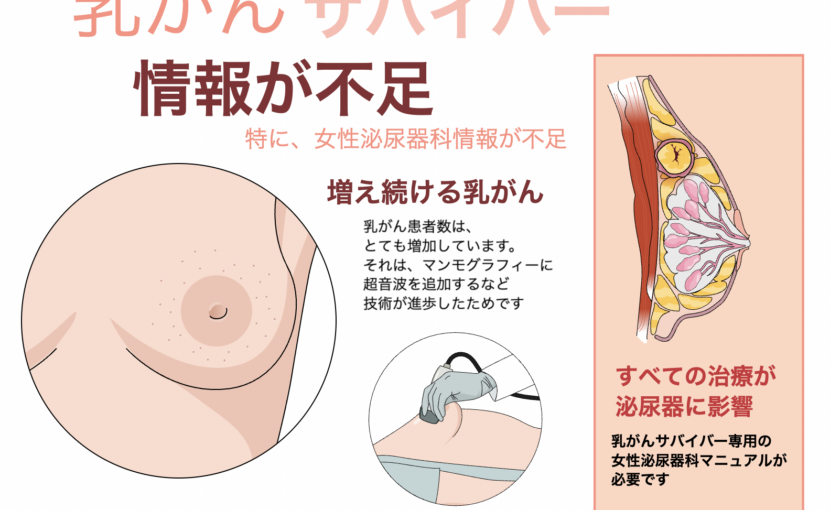
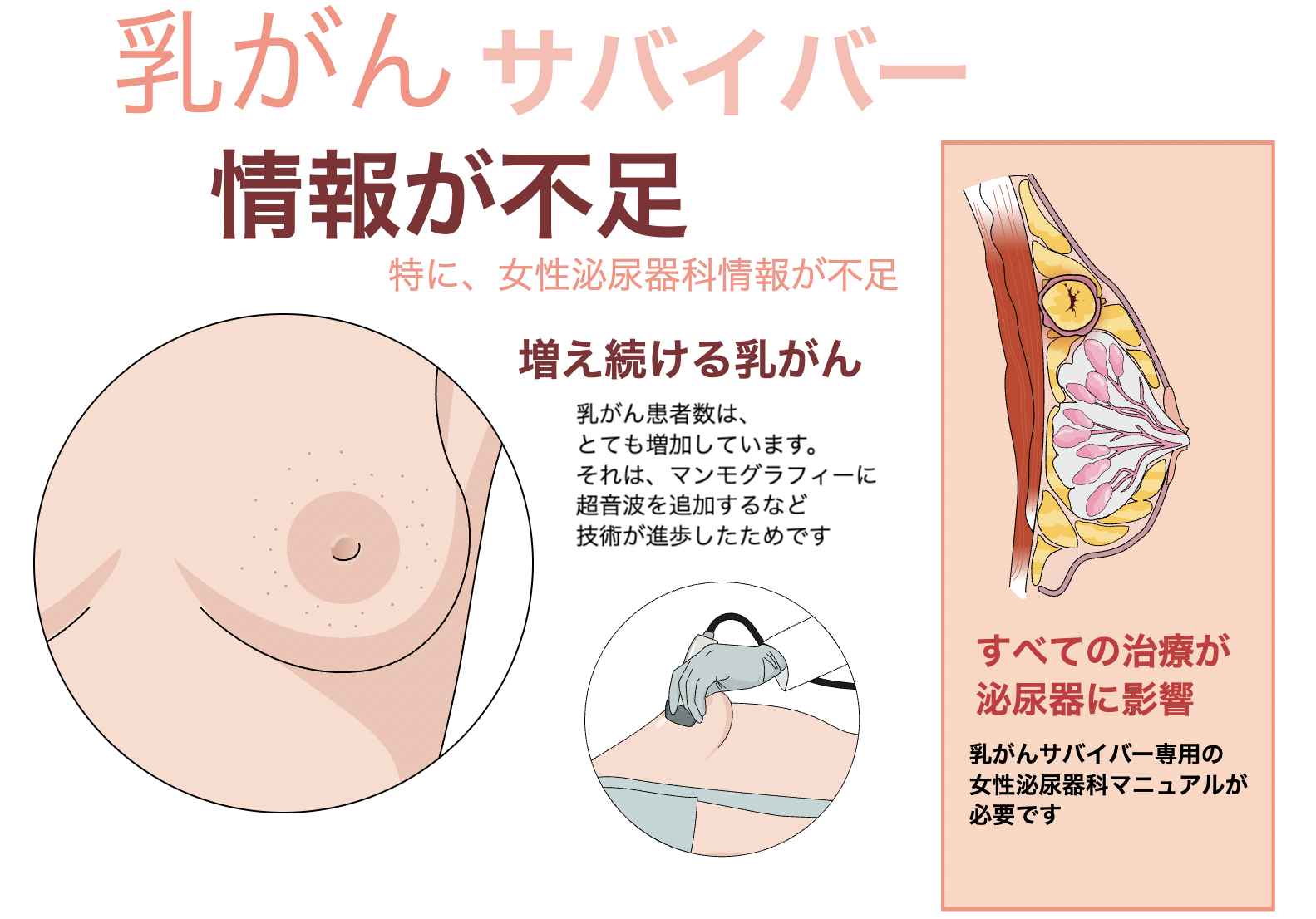
乳がんサバイバーの女性泌尿器科治療マニュアルの注目すべき分野は、乳がん治療後の女性泌尿器科です。乳がん治療により、エストロゲンの減少による膣膣萎縮(VVA)や閉経期の生殖尿路症候群(GSM)などの症状が生じる可能性があります。GSMは膣の乾燥、かゆみ、灼熱感、性交痛、尿路の不調などの症状を特徴とします。
GSMは通常、時間が経過しても改善しづらい慢性の状態です。そのため、乳がんの経歴のある女性にとって、GSMの安全で効果的な治療法を見つけることは非常に重要です[2,5]。現在、膣レーザー療法は閉経後の女性の症状を改善する有望な結果を示しており、局所エストロゲン療法と同等の効果があるとされています。そのため、乳がんのサバイバー(BCSs)におけるその潜在的な利点を明らかにすることに多くの注目が集まっています[6-8]。また、GSMだでなく、骨盤底の病気というめで見ると、乳がん生存者における骨盤底障害の発症までの平均期間は3年でした。選択的エストロゲン受容体調節剤およびアロマターゼ阻害剤は、骨盤臓器脱および腹圧性尿失禁と関連し、一方、エストロゲン拮抗薬は切迫性尿失禁および下部尿路症状と関連していることがわかっています。
GSMの診断と評価
閉経後の女性にとって、膣膣萎縮(VVA)とGSMは大きな問題ですが、症状のある多くの女性はこれらを医学的な問題として認識していません。診断には、医療歴の包括的な評価と婦人科検査が必要です。GSMを特定するために、示唆的な症状について積極的に尋ねることが重要です[9]。
GSMにはいくつかの身体的な特徴が見られることがあります。それには、陰毛の減少または欠如、陰部のサイズの縮小、小陰唇の融合の可能性が含まれます。膣内部は狭くなり、乾燥し、薄い膣組織を持ち、時折艶めかしい外観を示すことがあります。さらに、膣の弾力性が低下し、子宮頸部が短くなり、膣からの赤みや点状の出血が見られるかもしれません。膣内の主要な細菌叢が変化することで、異常な膣分泌物が生じることがあります。尿路の所見では、尿道の萎縮と赤みが尿路の症状とともに見られるかもしれません。GSMの場合、膣の酸性度は通常、健康な膣のpH(約3.8〜4.5)と比較して高くなります(pH > 5.0)[2]。
GSM治療の効果を評価するためによく使用される研究指標には、ビジュアルアナログスケール(VAS)、膣健康指数スコア(VHIS)、膣成熟指数(VMI)、女性性機能指数(FSFI)、および乳がん患者用女性性機能指数(FSFI-BC)があります[10]。VASは症状の強度を主観的に測定します。FSFIは女性の性機能を六つのドメインで評価し、2から36のスコアを提供します(高いスコアほど性機能が良いことを示します)[11]。FSFI-BCはFSFIの適応バージョンで、乳がん患者向けに特別に設計されており、乳がんに関連する変化と疼痛経験に関連する2つの追加のサブスケールを組み込んでいます[11]。VHISは膣萎縮の程度を評価するために膣の弾力性、pH、上皮粘膜、分泌物、組織の水分など五つのパラメーターを評価します。総合スコアは5から25の範囲です(スコアが低いほど膣萎縮が顕著です)[12]。VHISの検査方法については、膣pHの測定に焦点を当てているため、議論があります。一方、VMIは三つの膣上皮細胞型(表層、中間、基底細胞)の比率を利用しており、客観的なツールとされています。膣萎縮はエストロゲンレベルが低い状態で起こると考えられ、基底細胞が増加します。ただし、VMIはGSMに関連する臨床試験ではあまり使用されていません[10,13]。GSMを包括的に評価するためには、主観的および客観的な評価ツールを組み合わせることが有益です[14]。
乳がん治療の影響
乳がんの治療は、複数の療法を組み合わせた包括的なアプローチを含みます。組み合わせ療法は治療の有効性と効率を向上させます。局所進行性または手術不能の腫瘍の場合、新たな治療法はそのサイズを減少させ、手術できる状態にするために使用されます[15]。化学療法は未熟な卵母細胞と周囲の顆粒細胞に毒性を引き起こし、卵巣卵胞を破壊することで、卵巣機能に悪影響を及ぼす可能性があります。その結果、治療誘発性の卵巣機能抑制が発生することがあります[16]。乳がんを含むがん治療は、化学療法や放射線療法を含めて、若い女性や少女の卵巣機能に大きな影響を及ぼすと考えられています。主要な考慮事項には健康への悪影響と不妊の損失が含まれます。これらの影響がGSMの発症に寄与する可能性が示唆されています[17]。
乳がんの大半の患者はホルモン受容体陽性の腫瘍を持っており、エストロゲン受容体(ER)および/またはプロゲステロン受容体(PR)の過剰発現が乳がんと診断された患者の最大77%で観察されています[18]。ERおよびPRに関する情報は患者管理に不可欠であり、ERおよびPRの半定量的評価は予後と治療にとって重要です[19]。ER陽性の乳がん患者のホルモン療法は通常、5〜10年間の標準治療として維持されます[20]。乳がん患者では、タモキシフェンまたはゴナドトロピン放出ホルモンアナログ剤が選択され、閉経後の女性ではタモキシフェンとアロマターゼ阻害剤(AIs)が適しています[20]。
これらの薬物は、豊富なERを持つ女性の生殖尿路の萎縮を引き起こす可能性があります[21]。異なるタイプの内分泌療法は、膣管に異なる影響を及ぼし、副作用の発生頻度と重症度にばらつきをもたらす可能性があります。
AIsは、アンドロゲンからエストロゲンの合成に関与する酵素を抑制します[22]。これらの薬物はエストロゲンの生理的濃度を低下させます[23]。さらに、AIsは膣組織内でアロマターゼを局所的に抑制することにより、GSMの症状の重症度を増加させる可能性があります。膣上皮の増殖の減少が、膣萎縮スコア、膣pH、および性機能の低下と関連している可能性が示唆されています[24-27]。
タモキシフェンは選択的ERモジュレーターで、その作用機序は正常な乳房と乳がん細胞の両方におけるERへの結合、エストロゲンと競合し、抗腫瘍効果を発揮することに関与します[28]。タモキシフェンは循環エストロゲンをブロックし[25]、乳房以外の組織でのエストロゲンの影響を抑制します。エストロゲンは膣乾燥を改善する可能性があるため[29]、タモキシフェン治療を受ける患者のGSM症状は高い発生率で報告されています[30]。
乳がんサバイバーにおけるGSMの有病率
閉経後の女性のうち、約84%が一般的に生殖尿路症状を経験します[2]。一方、乳がんサバイバー(BCSs)の中では、GSM症状の有病率がさらに高くなります[31]。横断的研究によれば、BCSsの35〜91%が少なくとも1つのGSM症状を経験していると報告されています。その中で、血管運動症状、性的な問題、気分の変動、睡眠障害は74%のケースで頻繁に報告されています[26,32,33]。膣の乾燥感や性交痛はBCSsの間でよく報告される症状です[31-35]。性的な困難さと膣の乾燥感は、閉経後のBCSsにおいて、閉経前のBCSsと比較して多く見られます(それぞれ38.7%対15.9%および61.5%対23.4%)[36]。また、内分泌療法に関連して治療アプローチの違いが観察され、AIsを受けるBCSsはタモキシフェン療法を受けるBCSsよりもGSM症状をより頻繁に報告しています[26,37,38]。さらに、タモキシフェンは膣分泌物の増加と関連しています[27,38]。
乳がん治療と尿路症状の関連性
乳がん治療を受ける女性における尿路症状に関する複数の研究があります。まず、Stahlschmidt らは、患者に対する経口ホルモン療法を受けている女性の尿路症状に焦点を当てました。研究結果によれば、尿失禁症状や過活動膀胱の症状が高い有病率で見られ、低い服従度や高齢の女性に影響を与えることが示唆されました。Araklitisらは、抗コリン薬を使用して過活動膀胱を治療する際の安全性に焦点を当てています。抗コリン薬の使用には認知機能の低下、認知症、または死亡のリスクが伴うことがあり、特に高齢者はリスクが高いです。また、ボツリヌス毒素や膣エストロゲンの使用にも注意が必要です。Chungらは、乳がんサバイバーにおける尿失禁(UI)に焦点を当てました。研究によれば、乳がん診断時にUIが非常に一般的であり、新たにUIが発症または悪化することが多いことが示されました。UIは生活の質に影響を与えるため、適切な治療戦略が必要です。Karaboyunらは、乳がん患者に対する補助ホルモン療法を受けている閉経前の女性患者における尿失禁(UI)を比較しました。研究結果によれば、タモキシフェンの使用はアロマターゼ阻害剤に比べてUIのリスクを高めることが示されました。年齢と高血圧もUIの独立した予測因子であることが示されました。これらの研究から分かるように、乳がん治療に伴う尿路症状は重要な問題であり、患者の生活の質や治療への服従度に影響を与える可能性があります。したがって、これらの症状に対する適切な管理と治療が必要です。
乳がんサバイバーのGSM治療オプション
閉経後の女性のGSM(女性の性器の乾燥と不快感)の症状を軽減するために、北米更年期学会の勧告には、非ホルモン性の保湿剤、膣用潤滑剤、低用量の膣用エストロゲン、膣用デヒドロエピアンドロステロン挿入物、オラルのオスペミフェン、および全身的なホルモン療法が含まれています。しかし、乳がん再発のリスクがあるため、エストロゲンを含む製品は乳がんサバイバーのGSM治療には適していないかもしれません。一方、非ホルモン療法を試しても依然として生殖器および尿路の症状が続く乳がんサバイバーに対して、アメリカ産婦人科医学会は低用量の膣用エストロゲン、デヒドロエピアンドロステロン、またはテストステロンの補充を検討することを提案しています。非ホルモン性の膣用ゲルや保湿剤の化学組成は多様であり、非生理学的なpH、浸透圧、および添加物が有害な影響を及ぼす可能性があるため、長期間の治療に適しているかどうかについての不確実性があります。発がんのリスクが高まることは、膣内ホルモン療法の処方を妨げています。そんな場合に開発された新しい代替策が、革新的な膣レーザー療法です。
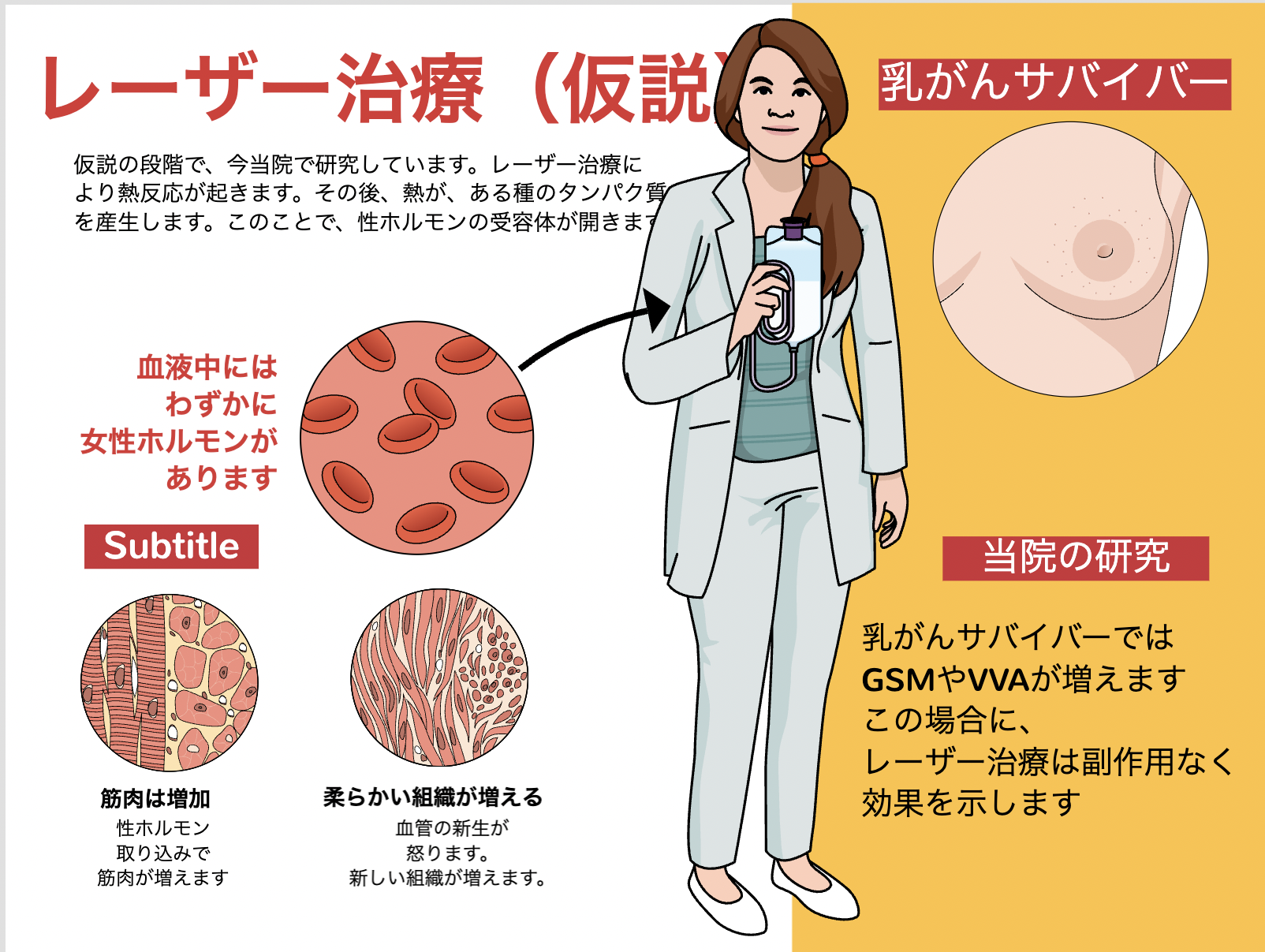
レーザー治療の種類
GSMの症状を軽減するために最も広く研究されている2つのレーザーは、非創傷性のエルビウムイットリウムアルミニウムガーネットレーザー(Er:YAGレーザー)レーザーとマイクロ創傷性の二酸化炭素(CO2)レーザーです。これら2つのレーザーは、活性媒体、波長、水の吸収など、異なる特性を持っています. 二酸化炭素(CO2)レーザーは、2023年の日本産婦人科ガイドラインでは推薦されない治療になっています。今後は、以下に詳しく記されたEr:YAGレーザーがいかに認められていくかということになります。
非創傷性のEr:YAGレーザーは、粘膜を切らずに深部を加熱します。2,940 nmで光を放射し、水中で非常に吸収されます。レーザーのエネルギーは、上皮の上5μmで急速に吸収され、光エネルギーを熱に変換します。2つのメカニズムがあります。最初のメカニズムは、適切な数のパルス(約4-7)と理想的な長いパルスシーケンスの時間(約1-3秒)を使用します。これにより、露出時間を短く保ちつつ、表面組織の反応を最大化し、中程度の凝固深度を実現します。2番目のメカニズムでは、より多くのパルス(通常10-30)が供給され、非常に長いパルスシーケンス(5秒以上)と局所麻酔が組み合わさります。この組み合わせにより、表面から400-500μmの深さで65°Cから45°Cまでの温度が実現します。これは一般的に「スムースリサーフェス」と呼ばれています。
さらに、この非創傷性のEr:YAGレーザーは、ネオジウム:イットリウムアルミニウムガーネット(Nd:YAG)レーザーと組み合わせて使用されます。この構成では、両波長で同時に照射する利点があります。Nd:YAGレーザーはヘモグロビンによく吸収されるため、皮膚に直接照射することで内部に熱を効率的に供給できます。
分数化マイクロ創傷性CO2レーザーは、ガス媒体を使用し、10,600 nmの波長でパルスを放射します。このレーザーの組織への吸収はEr:YAGよりも約10倍低いです。また、CO2レーザー技術は高いパルスエネルギーの短いレーザーパルスを生成するために最適ではありません。そのため、CO2レーザーは大きなレーザースポット直径の非創傷性治療に適していません。代わりに、CO2レーザーは主に分数化創傷モードで使用され、膣組織にいくつかの小さなビーム径の穴を開けることに使用されます。
現代のレーザー治療の登場により、以前の確立された理論に挑戦が起こりました。以前の理論であるアレニウスモデルでは、反応速度は温度と指数関数的に増加するとされていました。しかし、レーザー治療のメカニズムは、通常のアレニウスモデルとは異なる可変熱ショック応答モデルとして特徴付けられるべきであり、特に非常に短い露出時間の間に通常のアレニウスモデルから予想されるよりも高い組織損傷の臨界温度へのシフトが観察された非創傷性Er:YAGレーザー治療の調査で観察されました。この現象を説明するために、Lukač博士は新しいモデルである可変熱ショック応答モデルを導入し、短時間および長時間の露出中に細胞の生存と組織の損傷を調節する2つの生化学的プロセスの相乗的な影響を示唆しました。Lukač博士は、強い熱ショックバイオモジュレーションを発見し、レーザー生成の熱が細胞応答を促し、成長因子を放出し、細胞成長を増強することを示しました。強い熱ショックバイオモジュレーションは、組織再生を支援しながら損傷を回避するためにEr:YAGレーザーを使用する制御された強い熱ショックを提供します。
レーザー治療後の膣組織の組織学的変化
現在、BCS向けのレーザー治療の組織学的調査はありませんが、一般的な情報は利用可能です。可変熱ショック応答モデルによれば、Er:YAGレーザーとCO2レーザーは組織のリモデリングと若返りを刺激し、コラーゲンの新生、弾性線維の形成、および血管新生を促進します。Er:YAGレーザーのプロセスはコラーゲンのリモデリングと新血管の開始につながります。これらの効果は組織学的研究で確認されています。
膣粘膜サンプルの形態計測分析によれば、Er:YAGレーザー照射は上皮層の厚さと毛細血管の数および体積密度を増加させます。膣生検サンプルの分析では、炎症反応の兆候は見られず、好中球や好塩基球の浸潤も観察されませんでした。治療前の上皮層の平均厚さは45.0μmで、Er:YAGレーザー治療後、平均上皮層の厚さは152.9μmに増加しました。間質性膀胱炎を持つ患者の膣壁の病理学的研究では、治療前の膣壁の平均厚さは57.3±14.2μmで、Er:YAGレーザー治療後に133.3±24.5μmに増加したと報告されています。硬化性扁平苔癬を持つ40人の患者を対象としたEr:YAGレーザー治療のRCTでは、硬化の厚さは治療後に有意に減少しました(-0.67mm、95%信頼区間:-0.99から-0.34mm、P = 0.009)。対照群のコルチコステロイド治療後には厚さに有意な変化は見られませんでした(-0.10mm、95%信頼区間:-0.48から0.20mm、P = 0.577)。
BCSにおける膣レーザー療法の効果
BCSに対する局所エストロゲンの使用は議論の余地があります。膣内エストロゲンの使用が血清エストロゲンレベルを上昇させ、乳がんの進行や再発リスクを高めるかどうかについての対立する証拠が存在します。現在、乳がん患者における局所エストロゲン治療の安全性について確立された回答はなく、治療を避ける傾向があるため、彼らの生活の質に悪影響を及ぼす可能性があります。
VVA症状を持つBCSを対象とした多くの研究で膣レーザー療法が評価されています(表1)。しかし、現在利用可能なのは1つの無作為化比較試験(RCT)だけです。MensionらによるRCTでは、VVA症状を持つ35人のBCSがAIsを受けており、膣CO2レーザー治療は1か月後のフォローアップでプラセボ治療と同等の効果が示されました。さらに、いくつかの研究は主に単アームの前向きデザインを採用し、4つの後ろ向き研究があります。サンプルサイズは比較的小さく、16人から234人の患者までさまざまです。
BCSにおいてEr:YAGおよびCO2レーザーを使用したさまざまな設定が使用されています。研究プロトコルは、3回から5回のレーザーセッションで、4〜8週間の間隔で行われました。多くの研究では通常3回のレーザー治療が使用されています。最近では、膣と外陰部全体へのレーザー照射がより効果的であると提案されています。
Er:YAGおよびCO2レーザーは膣の健康を改善すると報告されています。VVA症状の改善は0から10のVASを使用して評価されました。治療により膣萎縮が回復し、生活の質が著しく向上しました。性機能をFSFIや女性の性的苦痛尺度のスコアを使用して評価した研究でも、膣の健康状態の改善が確認されました。これらの研究は24か月や18か月といった長期のフォローアップ期間を実施しました。多くの研究で調査期間は1か月から12か月にわたりました。BCSにおけるGSM症状の改善の持続性を評価した研究も4つあり、その結果は有望でした。治療後2年経過後も性機能が改善されたと指摘することで、レーザー療法の潜在的な長期的な利点を強調しました。また、Veronらは18か月のフォローアップ研究を通じて尿路および性機能の持続的な改善を示しました。しかし、治療後6か月以降、効果が減少する傾向が見られました。SiliquiniらはBCSにおいて治療完了後も最大12か月までの改善を報告しました。Gambaccianiらは、レーザー治療の効果が持続する期間を12〜18か月と示しています。
Salvatoreらは、VVA症状に対するマイクロ創傷性CO2レーザー療法の効果を評価した40人のBCSを対象とした研究を報告しました。参加者はホルモン療法の状態に基づいて2つのグループに分けられました。この研究では、ホルモン療法の有無にかかわらず、VVA症状、膣の健康、性機能における有意な違いは見られなかったため、補助療法は治療成績に影響を与えない可能性が示唆されました。Paganoらは、年齢や補助療法のタイプに関係なく、多変量解析でCO2レーザー療法の効果が82人のBCSにおいて有意であることを報告しました。
OkuiらとFidecicchiらの研究では、BCSにおいて膣だけでなく外陰部全体にレーザー療法を拡大することで治療効果が向上することが示され、BCSにおけるGSMの原因が膣に限定されていない可能性が示唆されました。Cucinellaらは、膣Er:YAGレーザーと局所ヒアルロン酸は、BCSにおける泌尿生殖器症状に対処する安全な選択肢であると、レビューされた研究から結論づけました。両治療法は尿路生殖器の健康と生活の質の改善を示しました。
膣レーザー手術の安全性
2018年、米国食品医薬品局(FDA)は、レーザーや電波周波数を用いた更年期に関連する生殖器障害、膣の若返り、膣の美容手術の治療に関してエネルギーベースのデバイスの使用に関する警告を発表しました[77]。米国泌尿器科学会は、膣エネルギーベースデバイスの使用に関する証拠が限られている状況に適用される臨床的な合意見解を提供する必要性を確認し、膣エネルギーベースデバイスの使用に関する最も重要な専門家の意見をまとめるために専門家パネルを招集しました[78]。Guoらは、2019年9月以前に発表された記事を対象にシステマティックレビューを実施し、29の推定されるレーザー関連の合併症を詳細に説明した3つの出版物を明らかにしました。そのうち5つ(17.2%)だけが治療後の症状の悪化を報告していなかった[79]。GuoらはFDAの安全性に関するコミュニケーションが裏付けを欠いていると指摘し、追加の試験を求めています[79]。Gambaccianiらは、非創膣Er:YAGレーザー治療に関連する有害事象の頻度に関する情報を、113,174人の患者から収集しました。彼らは62,727人の患者から詳細な情報を提供し、43,095人の患者の集団で観察された有害事象の頻度について情報を提供しました。彼らは観察されたすべての有害事象が軽度から中等度であり、一過性で低頻度であると報告しました[80]。GambaccianiとCervigniは、FDAの警告に言及し、創膣CO2レーザーがストレス性尿失禁とGSMの治療において承認されておらず、重大な有害事象と関連付けられる可能性があることを強調しました[81]。さらに、非創膣Er:YAGレーザーの治療効果と安全性について報告しました[80,81]。
評価されたすべての研究は、重大な有害事象は報告されなかったため、研究の一貫性が確保されました。3つの長期観察研究では、重大な有害事象は観察されませんでした[8,60,63]。RCTでは、膣レーザー治療群は、対照群と比較して有害事象の増加はありませんでした[61]。一部の患者はプローブ挿入時に不快感と疼痛を報告しました[60,61,63,66]が、これらの副作用は軽度で、患者は数日で回復しました。複数の研究では、3回のレーザーセッション後に膣手術に関連する不快感が減少したと報告されています。膣レーザー照射後の不快感を軽減するという報告もあります。膣レーザー治療のパラメータ設定が適切であれば、副作用は発生しないと考えられています。これらの条件の下で、GSMに関連する症状を安全に対処できると考えられています。
合わせて読みたい
女性泌尿器科専門人工知能 ”aiまちこ先生(β版)” ができました